
テムセル®HS注 Q&A
テムセルⓇHS注は薬価基準に収載されている製品ですが、医薬品ではなく「再生医療等製品」に分類されます。
再生医療等製品は、以下に掲げる製品であって、政令*で定めるものをいいます。
- (1)人又は動物の細胞に培養等の加工を施したものであって、
- イ 身体の構造・機能の再建・修復・形成するもの
- ロ 疾病の治療・予防を目的として使用するもの
- (2)遺伝子治療を目的として、人の細胞に導入して使用するもの
また、「生物由来製品及び特定生物由来製品並びに指定再生医療等製品の指定に関する考え方」(平成26年11月5日付け薬食審査発1105第1号及び薬食機参発1105第2号)に基づき、本品は同種の骨髄由来間葉系幹細胞を原料とする再生医療等製品であること、加えてその製造工程において病原体に対する不活化もしくは除去処理を行うことが困難であるものであることから、指定再生医療等製品に指定されております。
非造血系の接着性および自己複製能を持ち、試験管内で脂肪、骨、軟骨への分化能を有する細胞集団として単離された骨髄間質細胞の一種です。
本品の原材料となるヒト骨髄液は、適格性が確認された健康成人ドナーより採取されたものです。骨髄液採取時には、以下の適格性を確認しています。
- (1)既往歴、感染症歴、渡航歴等に係る問診。
- (2)ヒト免疫不全ウイルス(HIV-1、HIV-2)、C型肝炎ウイルス(HCV)、B型肝炎ウイルス(HBV)、ヒトT細胞白血病ウイルス(HTLV-1、HTLV-2)、梅毒トレポネーマ、西ナイル熱ウイルス、サイトメガロウイルス(CMV)、エプスタイン・バーウイルス(EBV)、パルボウイルスB19(B19)及びシャーガス病トリパノソーマが陰性であること。
クリーンベンチ、ウォーターバス、防護手袋、消毒アルコール、チャック付ポリ袋、生理食塩液、シリンジ、注射針、操作アダプター等が本品の調製に使用する推奨設備・機器・資材になります。
本品は希釈後、室温で保管し、3時間以内に投与を開始してください。
再使用とは、投与後の残液を他の患者さんへ投与することになります。
投与後の残液は、確実に破棄していただくようにお願い致します。
投与した日を含め3日以上あけて投与してください。
●具体例:月→木、火→金
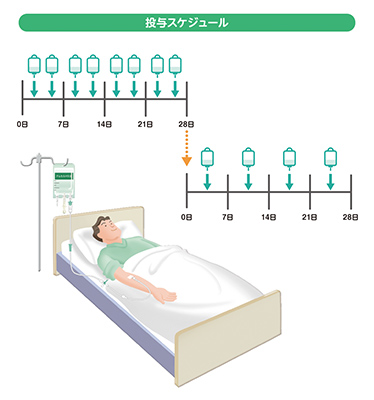
テムセルⓇHS注は、原則として週に2回、3日以上間隔をあけて、4週間点滴投与します。
ただし、症状の程度に応じて、さらに週に1回、4週間、継続して投与します。
テムセルⓇHS注に関する市販後調査は、厚生労働大臣より本品を使用した全例を調査するよう指示されています。本品の使用に関するデータは一般社団法人日本造血細胞移植データセンターが運営している造血細胞移植登録一元管理プログラム(TRUMP)に入力されることで一元管理しています。
JCRファーマ株式会社
Copyright2016, JCR Pharmaceuticals Co., Ltd. All Rights Reserved.

















