
臨床成績
国内第Ⅰ/Ⅱ相臨床試験(JR-031-201試験)3)
3)社内資料:同種造血幹細胞移植後に発症した標準治療抵抗性の急性移植片対宿主病(急性GVHD)に対するJR-031投与の第Ⅰ/Ⅱ相試験
(JR-031-201)及び継続調査(JR-031-202)(承認時評価資料)
1. 各時点までの最大治療効果判定
初回投与時から4週後までにCRと判断された患者は14例中8例(57.1%、両側95%信頼区間:28.9〜82.3)、PRと判断された患者は14例中5例(35.7%、両側95%信頼区間:12.8〜64.9)でした。
初回投与時から12週後までにCRと判断された患者は14例中12例(85.7%、両側95%信頼区間:57.2〜98.2)、PRと判断された患者は14例中1例(7.1%、両側95%信頼区間:0.2〜33.9)であり、4週後までの評価においてPRであった患者5例のうち4例が12週後までにCRに至りました。
4週後までの最大治療効果判定
| 初回投与時の GVHDグレード |
グレードⅡ (n=9) |
グレードⅢ (n=5) |
全体(n=14) | ||
|---|---|---|---|---|---|
| 最大治療効果判定 | 例数 | 例数 | 例数 | 割合(%) | 両側95%信頼区間 |
| 全反応:OR | 9 | 4 | 13 | 92.9 | 66.1〜99.8 |
| 完全反応:CR | 6 | 2 | 8 | 57.1 | 28.9〜82.3 |
| 部分反応:PR | 3 | 2 | 5 | 35.7 | 12.8〜64.9 |
| 混合反応:MR | 0 | 0 | 0 | 0.0 | 0.0〜23.2 |
| 悪化:PG | 0 | 1 | 1 | 7.1 | 0.2〜33.9 |
| 変化なし:NC | 0 | 0 | 0 | 0.0 | 0.0〜23.2 |
12週後までの最大治療効果判定
| 最大治療効果判定 | 例数(n=14) | 割合(%) | 両側95%信頼区間 |
|---|---|---|---|
| 全反応:OR | 13 | 92.9 | 66.1〜99.8 |
| 完全反応:CR | 12 | 85.7 | 57.2〜98.2 |
| 部分反応:PR | 1 | 7.1 | 0.2〜33.9 |
| 混合反応:MR | 0 | 0.0 | 0.0〜23.2 |
| 悪化:PG | 1 | 7.1 | 0.2〜33.9 |
| 変化なし:NC | 0 | 0.0 | 0.0〜23.2 |
2. 24週後までの期間におけるCR継続期間
初回投与時から24週後までの期間に28日間以上CRが継続した患者は14例中10例(71.4%、両側95%信頼区間:41.9〜91.6)でした。
24週後までの期間におけるCR継続期間
| 初回投与時の GVHDグレード |
グレードⅡ (n=9) |
グレードⅢ (n=5) |
全体(n=14) | ||
|---|---|---|---|---|---|
| CR継続期間※1 | 例数 | 例数 | 例数 | 割合(%) | 両側95%信頼区間 |
| 28日以上 | 7 | 3 | 10 | 71.4 | 41.9〜91.6 |
| 56日〜 | 6 | 3 | 9 | 64.3 | ― |
| 28〜55日 | 1 | 0 | 1 | 7.1 | ― |
| 14〜27日 | 1 | 1 | 2 | 14.3 | ― |
| 7〜13日 | 0 | 0 | 0 | 0.0 | ― |
| 0〜6日 | 0 | 0 | 0 | 0.0 | ― |
- ※1:GVHDが再燃した場合:CR継続期間(日)=(GVHD再燃の発現日)-(CRの発現日)
CRのまま終了した場合:CR継続期間(日)=(最終のGVHD評価日)-(CR発現日)+1
3. 各時点における治療効果判定
初回投与時から24週後にかけての各時点においてORと判断された患者は、4週後は12例中12例(100.0%、両側95%信頼区間:73.5〜100.0)、12週後は12例中12例(100.0%、両側95%信頼区間:73.5〜100.0)、24週後は11例中11例(100.0%、両側95%信頼区間:71.5〜100.0)でした。
- 注:評価時点までに死亡した患者は解析から除外した
初回投与4週後の時点の治療効果判定
| 初回投与時の GVHDグレード |
グレードⅡ (n=8) |
グレードⅢ (n=4) |
全体(n=12) | ||
|---|---|---|---|---|---|
| 最大治療効果判定 | 例数 | 例数 | 例数 | 割合(%) | 両側95%信頼区間 |
| 全反応:OR | 8 | 4 | 12 | 100.0 | 73.5〜100.0 |
| 完全反応:CR | 5 | 1 | 6 | 50.0 | 21.1〜78.9 |
| 部分反応:PR | 3 | 3 | 6 | 50.0 | 21.1〜78.9 |
| 混合反応:MR | 0 | 0 | 0 | 0.0 | 0.0〜26.5 |
| 悪化:PG | 0 | 0 | 0 | 0.0 | 0.0〜26.5 |
| 変化なし:NC | 0 | 0 | 0 | 0.0 | 0.0〜26.5 |
初回投与12週後の時点の治療効果判定
| 最大治療効果判定 | 例数(n=12) | 割合(%) | 両側95%信頼区間 |
|---|---|---|---|
| 全反応:OR | 12 | 100.0 | 73.5〜100.0 |
| 完全反応:CR | 10 | 83.3 | 51.6〜97.9 |
| 部分反応:PR | 2 | 16.7 | 2.1〜48.4 |
| 混合反応:MR | 0 | 0.0 | 0.0〜26.5 |
| 悪化:PG | 0 | 0.0 | 0.0〜26.5 |
| 変化なし:NC | 0 | 0.0 | 0.0〜26.5 |
初回投与24週後の時点の治療効果判定
| 最大治療効果判定 | 例数(n=11) | 割合(%) | 両側95%信頼区間 |
|---|---|---|---|
| 全反応:OR | 11 | 100.0 | 71.5〜100.0 |
| 完全反応:CR | 10 | 90.9 | 58.7〜99.8 |
| 部分反応:PR | 1 | 9.1 | 0.2〜41.3 |
| 混合反応:MR | 0 | 0.0 | 0.0〜28.5 |
| 悪化:PG | 0 | 0.0 | 0.0〜28.5 |
| 変化なし:NC | 0 | 0.0 | 0.0〜28.5 |
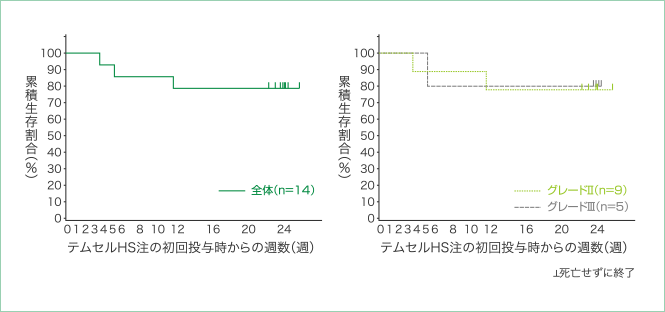
4. 24週後までの生存率
本品を投与した14例の患者のうち、12週後まで生存していた患者は12例(85.7%、両側95%信頼区間:57.2〜98.2)でした。その後、100日後までに1例の死亡が確認され、24週後まで生存していた患者は14例中11例(78.6%、両側95%信頼区間:49.2〜95.3)でした。
24週後までの生存率
| 初回投与時の GVHDグレード |
グレードⅡ (n=9) |
グレードⅢ (n=5) |
全体(n=14) | ||
|---|---|---|---|---|---|
| 生存者数 | 例数 | 例数 | 例数 | 割合(%) | 両側95%信頼区間 |
| 12週後 | 8 | 4 | 12 | 85.7 | 57.2〜98.2 |
| 100日後 | 7 | 4 | 11 | 78.6 | 49.2〜95.3 |
| 24週後 | 7 | 4 | 11 | 78.6 | 49.2〜95.3 |
24週後までの生存曲線
5. 副腎皮質ステロイド剤の投与量
本品初回投与時の副腎皮質ステロイド剤の一日投与量の平均値は68.17mgと最も多く、4週後の時点で30.70mg、8週後の時点で17.56mgまで減少していることを確認しました。
副腎皮質ステロイド剤の投与量※1,※2の分布
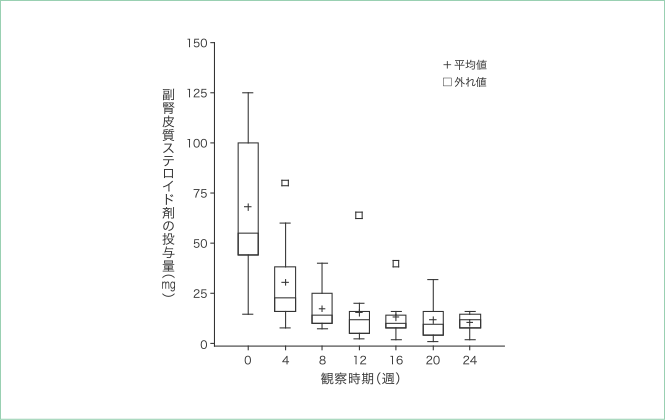
- ※1:当該観察時期のGVHD評価日に使用された副腎皮質ステロイド剤の投与量
- ※2:本試験で使用された副腎皮質ステロイド剤は、メチルプレドニゾロン(mPSL)かプレドニゾロン(PSL)のいずれかで、PSLを使用している場合にはPSL1.25mgをmPSL1.0mgと換算し、mPSL換算量として集計した
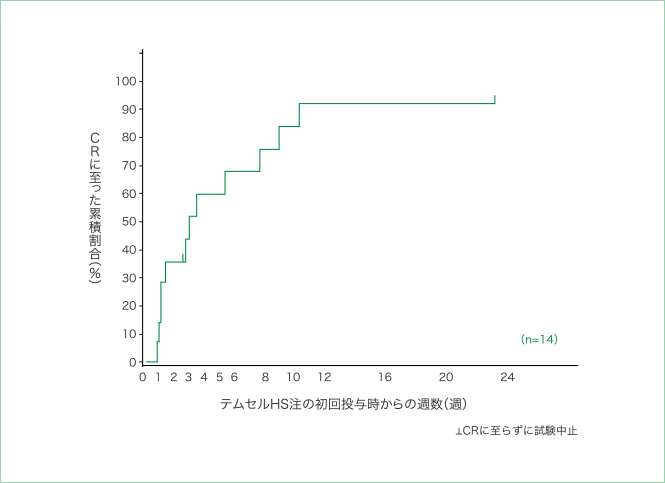
6. CRに至るまでの期間
初回投与時から24週後までにCRに至った患者は14例中12例でした。そのうち初回投与時から27日までの期間にCRに至った患者が8例と多くを占めていましたが、CRに至るまでの期間について顕著な傾向は みられませんでした。
CRに至るまでの期間
| CRに至るまでの期間※1 | CRに至った例数 | 割合(%) |
|---|---|---|
| 0日〜6日 | 2 | 14.3 |
| 7日〜13日 | 3 | 21.4 |
| 14日〜27日 | 3 | 21.4 |
| 28日〜55日 | 2 | 14.3 |
| 56日以上 | 2 | 14.3 |
- n=14
- ※1: 初回投与時からCRに至るまでの期間(日)=(最初のCR発現日)-(初回投与日)
CRに至るまでの期間のKaplan-Meier曲線
7. 各臓器別の治療効果判定
初回投与時に皮膚の症状を有した9例のうち、4週後までに一度は皮膚障害が消失した患者は6例でした。
初回投与時に肝臓の症状を有した4例のうち、4週後までに一度は肝障害が消失した患者は2例でした。
初回投与時に消化管の症状を有した10例のうち、4週後までに一度は消化管障害が消失した患者は8例でした。また、皮膚の症状を有した患者9例中8例、肝臓の症状を有した患者4例中3例、消化管の症状を有した患者11例中10例は、12週後までに一度は臓器障害が消失しました。
各臓器別の4週後までの最大治療効果判定
| 臓器 | 皮膚(n=9)※1 | 肝臓(n=4)※1 | 消化管(n=10)※1 |
|---|---|---|---|
| 最大治療効果判定 | 例数 | 例数 | 例数 |
| 全反応:OR | 9 | 3 | 9 |
| 完全反応:CR | 6 | 2 | 8 |
| 部分反応:PR | 3 | 1 | 1 |
- ※1:臓器ごとのステージが初回投与時以降すべて「0」の場合は対象外
各臓器別の12週後までの最大治療効果判定
| 臓器 | 皮膚(n=9)※2 | 肝臓(n=4)※2 | 消化管(n=11)※2 |
|---|---|---|---|
| 最大治療効果判定 | 例数 | 例数 | 例数 |
| 全反応:OR | 9 | 3 | 10 |
| 完全反応:CR | 8 | 3 | 10 |
| 部分反応:PR | 1 | 0 | 0 |
- ※2:臓器ごとのステージが初回投与時以降すべて「0」の場合は対象外
JCRファーマ株式会社
Copyright2016, JCR Pharmaceuticals Co., Ltd. All Rights Reserved.


















